domingo, 12 de diciembre de 2010
domingo, 7 de noviembre de 2010
sábado, 16 de octubre de 2010
lunes, 5 de julio de 2010
Elementos de la tabla períodica
Consecuencias de la carencia de Yodo
La falta de yodo en el cuerpo puede ocasionar:
• Aumento de la glándula tiroides, esto se conoce como Bocio o Coto, y se manifiesta con un abultamiento en el cuello.
• Retardo en el crecimiento y el desarrollo.
El Yodo es un mineral indispensable para la formación de las hormonas tiroideas y por lo tanto es necesario para el buen funcionamiento de la glándula tiroides ubicada en el cuello. Las hormonas tiroideas ayudan al crecimiento y mejoran la agilidad mental. Además el yodo contribuye a quemar el exceso de grasa y a desarrollar las uñas, cabello, piel y dientes de manera óptima.
Consecuencias de la carencia de Yodo
La falta de yodo en el cuerpo puede ocasionar:
• Aumento de la glándula tiroides, esto se conoce como Bocio o Coto, y se manifiesta con un abultamiento en el cuello.
• Retardo en el crecimiento y el desarrollo.Fuentes principales de Yodo
Son varias las fuentes para la obtención de yodo:
• Sal marina
• Pescados
• Mariscos
• Algas y vegetales cultivados en suelos ricos en yodo
Debido a que algunas personas viven tan lejos del mar para poder aprovechar el yodo de las fuentes marinas, la forma más económica y sencilla es utilizando siempre la Sal Yodada en la preparación de las comidas. En los supermercados se puede encontrar la sal yodada, sólo hay que leer en el paquete para ver si contiene el yodo.
Medidas para combatir la deficiencia de Yodo
Para combatir la deficiencia de yodo las personas deben exigir en los abastos, bodegas y supermercados la sal yodada. En caso contrario, si no la hay para la venta, hacer la denuncia a las autoridades de Sanidad.
En Venezuela, entre el sector salud y educativo, la comunidad y la industria salinera se están desarrollando actividades de información, investigación y vigilancia para garantizar el consumo de la sal yodada en todos los hogares.
Recuerda:A pesar de que en los diferentes alimentos encontramos los minerales necesarios para el organismo, no debemos descuidar su consumo. Por esto:
• Consume sal yodada
• Incorpora a la rutina del cepillado una pasta dental que contenga flúor.
las necesidades de yodo varían a lo largo de la vida, y proporcionalmente son mayores en la edad infantil.
La dosis mínima de yodo recomendada es de tan solo 90µg/día desde el nacimiento hasta los 6 años, 120 µg/ día de los 6 a los 12años, 150 µg/ día en la edad adulta, y 250-300 µg/ día durante el embarazo y la lactancia. Las necesidades del prematuro se calculan en 30µg/Kg/día.
La cantidad de yodo necesario para toda una vida es de tan solo unos 4 g, pero es preciso ingerirlo diariamente porque no podemos almacenarlo en el organismo.
Pero estas necesidades no estan garantizadas con la dieta y
es preciso enriquecer los alimentos con yodo durante toda la vida,
y además, durante el embarazo y la lactancia suplementar la dieta con al menos 200 µg de yodo al día en forma de IK.
enlace químico
domingo, 13 de junio de 2010
POTENCIAL DE IONIZACIÓN
1er Potencial de ionización:
Energía necesaria para arrancar un e- de un átomo aislado en fase gaseosa en su estado fundamental y obtener un ion monopositivo gaseoso en su estado fundamental más un electrón sin energía cinética. Siempre se les asigna un valor positivo, por tratarse de una reacción endotérmica.
. Na(g) -------------------- Na+(g) + e-
2º Potencial de ionización:
Energía necesaria para arrancar a un ion monopositivo gaseoso en estado fundamental y obtener un ion dipositivo en las mismas condiciones mas un electrón sin energía cinética.
![]() Na+(g) ------------ Na2+(g) + e-
Na+(g) ------------ Na2+(g) + e-
Energía de ionización total para llegar a un ion determinado es la suma de los sucesivos potenciales de ionización.
- Las energías de ionización miden, por tanto, la fuerza con que el átomo retiene sus electrones. Energías pequeñas indican una fácil eliminación de electrones y por consiguiente una fácil formación de iones positivos.
- Los potenciales de ionización sucesivos para un mismo elemento crecen muy deprisa, debido a la dificultad creciente para arrancar un electrón cuando existe una carga positiva que le atrae y menos cargas negativas que le repelan.
- El conocimiento de los valores relativos de las energías de ionización sirve para predecir si un elemento tenderá a formar un compuesto iónico o covalente
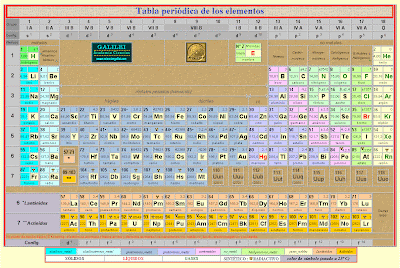
TABLA PERÍODICA
Tabla Periódica
Cuando los elementos se ordenan de acuerdo al número atómico creciente, se observa una repetición periódica de las propiedades físicas y químicas, tales como peso específico, punto de fusión, carácter metálico o electronegatividad. Se aconseja observar
· Las líneas horizontales se denominan períodos. La tabla consta de siete de ellos, y al pasar de un período a otro, se produce una repetición de propiedades. El número del período al cual pertenece un elemento coincide con el número de capas en las cuales su átomo contiene electrones. Por ejemplo el Na pertenece al tercer período, por lo que los electrones de átomo se distribuyen en tres capas.
· Las columnas se identifican mediante un número romano (I al VIII) y una letra (A o B). Existe también una columna 0 (cero). Los elementos que pertenecen a columnas con igual número tienen propiedades semejantes, y conforman un grupo. Dentro de cada grupo se presentan subgrupos o familias de elementos que, respondiendo a las propiedades generales del grupo, presentan otras características particulares, y se los distingue mediante una letra asociada al número.
· Los elementos que pertenecen a familias identificadas con la letra A y los del grupo 0 se denominan elementos representativos. Los restantes se denominan elementos de transición.
· Las dos filas separadas del grupo principal de la tabla se denominan elementos de transición interna. Debieron incluirse a continuación del La y Ac respectivamente, lo que no se hace por razones de espacio.
· La línea gruesa escalonada separa los elementos metálicos de los no metálicos (a izquierda y derecha respectivamente). Determinadas familias reciben nombres que reflejan alguna característica común a los elementos que las componen:
IA : Metales alcalinos
IIA : Metales alcalino térreos
VIA: Calcógenos
VIIA: Halógenos
0: Gases nOBLES
DE MARIA EUGENIA
sábado, 1 de mayo de 2010
Modelo actual y números cuánticos
domingo, 25 de abril de 2010

Los orbitales atómicos
Son regiones del espacio donde existe la probabilidad de
encontrar al electrón.En el modelo actual, los electrones
no circulan en órbitas, hoy se considera que tienen una
descripción ondulatoria.
Erwin Schrodinger propone un modelo para describir el
modelo del
átomo, este es un modelo matemático. La ecuación
Schrodinger
incorpora el comportamiento de las partículas en términos
de su masa
(m) y en términos de su comportamiento ondulatorio a través de una funsión de onda.
viernes, 23 de abril de 2010
domingo, 18 de abril de 2010
lineas espectrales


Cuando un electrón que ha saltado a niveles de mayor energía (estado excitado) y cae de nuevo a niveles de menor energía se produce la emisión de un fotón de una longitud de onda definida que aparece como una raya concreta en el espectro de emisión.
En cambio, cuando irradia una sustancia con luz blanca (radiación electromagnética continua) los electrones escogen las radiaciones de este espectro continuo para producir saltos a niveles superiores (estado excitado). Si recogemos la radiación electromagnética con la que hemos irradia do después de pasar por la sustancia vemos que le faltan una serie de líneas que corresponden con saltos electrónicos. Es lo que se denomina un espectro de absorción.
sábado, 17 de abril de 2010
El comportamiento ondulatorio de la materia
APORTES DE DE BROGLIE Y HEINSEMBERG
En 1924 De Broglie presenta su teoría denominada dualidad onda-partícula: una partícula lleva asociada siempre una onda. La longitud de onda λ (distancia entre dos máximos consecutivos de la onda) es inversamente proporcional al momento lineal p de la partícula, de acuerdo con la siguiente expresión:
λ = h/p → p = h/λ
De esta relación se deduce que cuanto mayor sea el momento lineal de la partícula menor será la longitud de onda que lleva asociada. Una consecuencia más importante de la naturaleza dual de la materia es el principio de incertidumbre de Heisemberg, enunciado en 1927. Dicho principio sostiene que es imposible especificar, simultáneamente y con exactitud, la posición y el momento lineal de una partícula, y se expresa matemáticamente de la forma siguiente:
(∆p)(∆x) ≥ h/4π
Según este principio no es posible atribuir al electrón órbitas precisas alrededor del núcleo, porque ello implicaría el conocer exactamente la posición y la velocidad del electrón en cada instante. En consecuencia, para discutir el movimiento del electrón, con una energía dada o velocidad conocida, alrededor del núcleo es necesario hablar en términos de probabilidad de encontrar a dicho electrón en una determinada posición.
El modelo de Niels Borh
 Bohr adoptó las idea de Planck de que las energías están cuantizadas
Bohr adoptó las idea de Planck de que las energías están cuantizadasBohr basó su modelo en tres postulados:
1.solo estan permitidas órbitas con ciertos radios, correspondientes a ciertas energías determinadas, para los electrones de un átomo
2- Un electrón en un nivel permitido tiene una energía específica y esta en un estado de energía permitido. Un electrón en un estado de energía permitido no irradia energía.
3- Un electrón solo emite o absorbe en forma de foton, E= h . u
martes, 13 de abril de 2010
modelo de Thomson
el modelo de Rutherford y la radiactividad

El modelo de Ernest Rutherford
En 1896, el científico frances Henry Becquerel al estar estudiando un mineral de uranio llamado pechblenda, descubrió que emitía espontáneamenteradiación de alta energía a lo que llamó Radiactividad.
En 1810 Rutherfor y sus colaboradores realizaron un experimento que acabó con el modelo de Thomson.
Rutherford estaba estudiando los ángulos con los que la partícula alfa
se dispersaba al pasar a través de una lámina de oro muy delgada.
(Ver la figura). Descubrierón que casi todas las partículas alfa ATRAVEZABAN DIRECTAMENTE LA LAMINA DE ORO SIN DESVIARSE.
sábado, 10 de abril de 2010
MODELO ATÓMICO DE DALTÓN

 La teoría de Dalton
La teoría de DaltonEl concepto de átomo surge
nuevamente en Europa
durante el siglo XVII cuando
los científicos trataron
de explicar las propiedades
de los gases.
Daltón después de numerosas
observaciones planteó
los siguientes postulados:
1-Cada elemento se compone de partículas extremadamente pequeñas llamadas átomos
2- Todos los elementos de un elemento dado son idénticos, los átomos de elementos diferentes son diferentes y tienen propiedades diferentes.
3-Los átomos de un elementos no se transforman en átomos diferentes durante las reacciones químicas, los átomos no se crean ni se destruyen en las reacciones químicas.
4-Cuando se combinan los átomos de más de un elemento se forman compuestos.
viernes, 9 de abril de 2010
sábado, 3 de abril de 2010
Capacitaciòn de docentes de Química en la UNSA
jueves, 25 de marzo de 2010
comenzaban las obras de la catedral. Pregunto a uno de los obreros
que era lo que estaban haciendo,”ya lo veis, estoy poniendo una
piedra encima de la otra”. Repitió la misma pregunta a otro peón de
la cuadrilla y recibió esta respuesta.”Estoy levantando una pared”.Un
tercero contestó. “Estoy construyendo una catedral”.
Los tres estaban haciendo lo mismo y las tres respuestas, aunque
diferente, eran correctas. El profesor que repite solamente una
lección tras otra, ofrece una explicación diferente que la de aquel que
sabe que está construyendo el conocimiento Y distinta, a su vez de
aquel que sabe que está formando ciudadanos para un mundo más
habitable, más humano y más hermoso”.
Miguel Santos Guerra.
jueves, 4 de marzo de 2010
HOLA A TODOS
hOLA MI NOMBRE ES MARIA EUGENIA HUARANCA
eSTA ES UNA OPORTUNIDAD DE APRENDER QUIMICA DE FORMA RECREATIVA
-
Estimados les sugiero visitar el blog del profesor de Juan Pablo Colotta en Blog de Química